16 june 2015
PHARMA NEWS
ฉบับประจำวันที่ 16 มิถุนายน 2558
ข่าวจากกลุ่มงานเภสัชกรรม
เปลี่ยนแปลงรายการยาในโรงพยาบาล
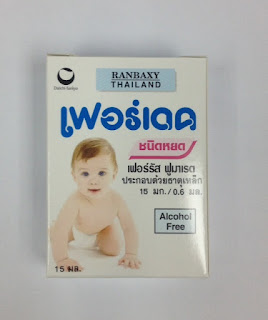
1. Ferrous Sulphate Drop
เปลี่ยนบริษัทจัดซื้อยา จากชื่อการค้า FERDEK DROPS ® (ferrous fumarate 45 mg. eqivalent to 15 mg. ferrous iron) ผลิตโดยบริษัท โอลิค(ประเทศไทย) เป็นชื่อการค้า PEDIRON IRON DROPS ® (ferrous sulphate 50 mg. eqivalent to 15 mg. ferrous iron) ผลิตโดย บริษัท ห้างยาไทย 1942 จำกัด
ชื่อสามัญทางยา : ferrous sulphate
ส่วนประกอบ : ใน 0.6 ml.(1 หลอดหยด) ประกอบด้วย เฟอรัส ซัลเฟต 50 mg. เทียบเท่ากับธาตุเหล็ก 15 mg.
ผลการติดตามการใช้ยา Calcitonin nasal spray
ปี 2555 คณะกรรมการด้านผลิตภัณฑ์ยาสำหรับใช้ในมนุษย์ หน่วยงานดูแลกำกับด้านยา ของสหภาพยุโรป ( European Medicines
Agency's C0mmittee for Medicinal Products for Human Use : CHPM) พบหลักฐานใช้ calcitonin ในระยาะยาว เมื่อเทียบกับผู้ที่ใช้
ยาหลอก มีความเสี่ยงที่จะเกิดมะเร็งเพิ่มขึ้น 0.7 % - 2.4 % ได้ประเมินประโยชน์และความเสี่ยงของยา ชนิดพ่นจมูกพบว่าประโยชน์ไม่
มากกว่า ความเสี่ยงที่พบ
ปี 2556 คณะกรรมาธิการยุโรป (European
Commission) ให้เพิกถอนยา calcitonin
ชนิดพ่นทางจมูกที่อนุมัติข้อบ่งใช้เฉพาะรักษา
ภาวะกระดูกพรุนภายหลังหมดประจำเดือน ออกจากท้องตลาดในสหภาพยุโรป
คณะกรรมการอาหารและยา
เสนอมาตรการการจัดการความเสี่ยงที่เหมาะสมสำหรับประเทศไทย คณะกรรมการยามีมติ คือ
1. ยกเลิกข้อบ่งใช้รักษาภาวะกระดูกพรุนของยา
calcitonin
ทุกรูปแบบ
2.
กำหนดให้ยา calcitonin
ทุกรูปแบบ
ต้องมีคำเตือนตาม กฏหมาย ดังนี้ “ มีรายงานว่าการใช้ยา
calcitonin
ชนิดพ่นจมูกในระยะยาวทำให้เพิ่มความเสี่ยงเป็นมะเร็ง”
โรงพยาบาลพุทธโสธร จึงได้ติดตามการสั่งใช้ยา calcitonin nasal spray ในโรงพยาบาล ผลการติดตามเป็นดังนี้
ในเดือน กุมภาพันธ์ ถึง เดือน เมษายน 2558 มีผู้ป่วยได้รับยา calcitonin nasal spray ทั้งหมด 78
คน มีการสั่งใช้ยา ตรงตามข้อบ่งใช้ ใช้ในการรักษาโรคกระดูกพรุน และไม่สามารถระบุข้อบ่งใช้ ได้
ดังกราฟ
จากกราฟ จะเห็นได้ว่ามีการสั่งใช้ยา ตรงตามข้อบ่งใช้ ร้อยละ 34.62 คณะกรรมการเภสัชกรรมและการบำบัด จึงได้มอบหมายให้ กลุ่ม
งานออโธปิดิกส์ จัดทำแนวทางในการสั่งใช้ยา calcitonin nasal spray และจะทำการติดตามความเหมาะสมในการสั่งใช้ยาต่อไป









mifimaute-Cary Matt Palma click here
ตอบลบtralentome